Lý thuyết: Sơ lược về bảng tuần trả những nhân tố hóa học
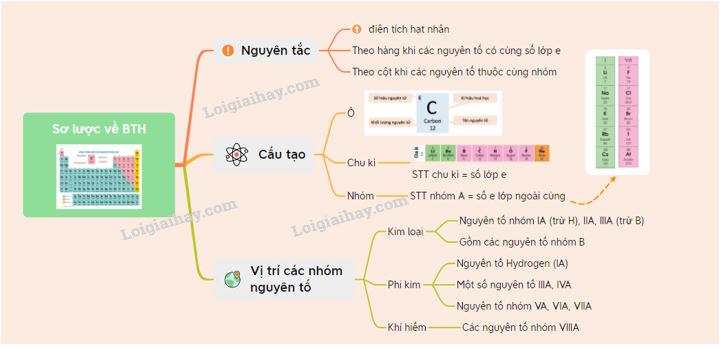
I. Nguyên tắc bố trí những nhân tố chất hóa học vô bảng tuần hoàn
- Năm 1869, căn nhà bác bỏ học tập người Nga D. I. Mendeleev đang được xây đắp bảng tuần trả theo hướng tăng dần dần lượng vẹn toàn tử.
- Các căn nhà khoa học tập tân tiến đang được minh chứng rằng năng lượng điện phân tử nhân vẹn toàn tử mới nhất là hạ tầng nhằm xây đắp bảng tuần trả.
- Hiện ni, bảng tuần trả những nhân tố hoá học tập bao gồm 118 nhân tố được xây đắp theo đòi qui định sau:
+ Các nhân tố chất hóa học được bố trí theo hướng tăng dần dần của năng lượng điện phân tử nhân.
+ Các nhân tố chất hóa học vô và một sản phẩm với nằm trong số lớp electron vô vẹn toàn tử.
+ Các nhân tố chất hóa học vô và một cột với đặc điểm chất hóa học tương tự nhau.

Một kiểu bảng tuần trả những nhân tố hoá học
II. Cấu tạo ra bảng tuần trả những nhân tố hóa học
1. Ô vẹn toàn tố
- Mỗi nhân tố hoá học tập được bố trí vào trong 1 dù của bảng tuần trả, được gọi là dù nhân tố.
Ví dụ 1: Ô nhân tố carbon hỗ trợ những vấn đề về vẹn toàn tử carbon.
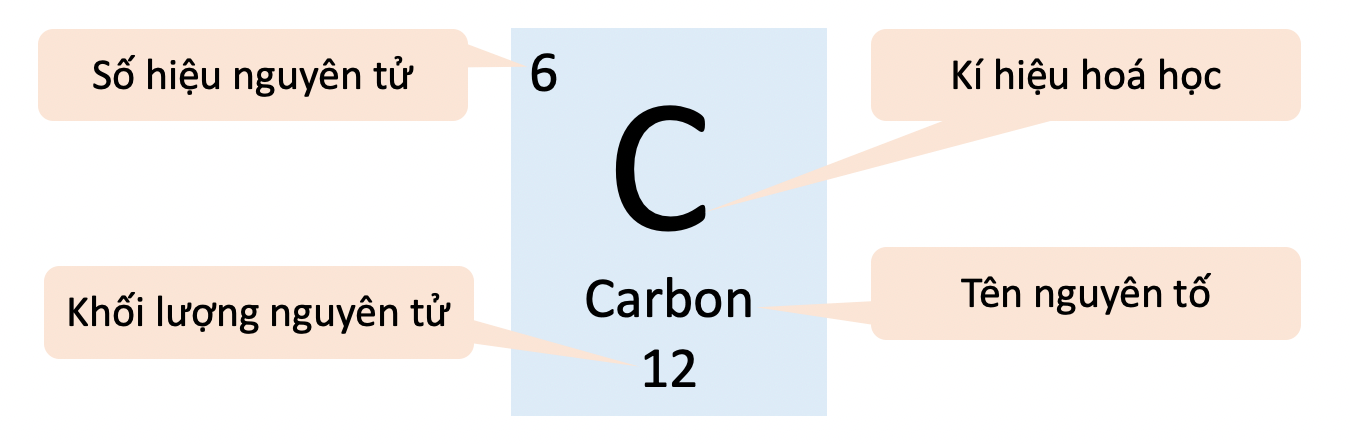 - Ô nhân tố mang lại biết:
- Ô nhân tố mang lại biết:
+ Số hiệu vẹn toàn tử (Z).
+ Kí hiệu hoá học tập.
+ Tên nhân tố.
+ Khối lượng vẹn toàn tử.
- Số hiệu vẹn toàn tử (Z) = số đơn vị chức năng năng lượng điện phân tử nhân = số electron vô vẹn toàn tử = số trật tự của nhân tố vô bảng tuần trả.
2. Chu kì
- Chu kì bao gồm những nhân tố tuy nhiên vẹn toàn tử của bọn chúng với nằm trong số lớp electron và được bố trí trở thành sản phẩm theo đòi năng lượng điện phân tử nhân tăng dần dần kể từ trái ngược qua loa nên.
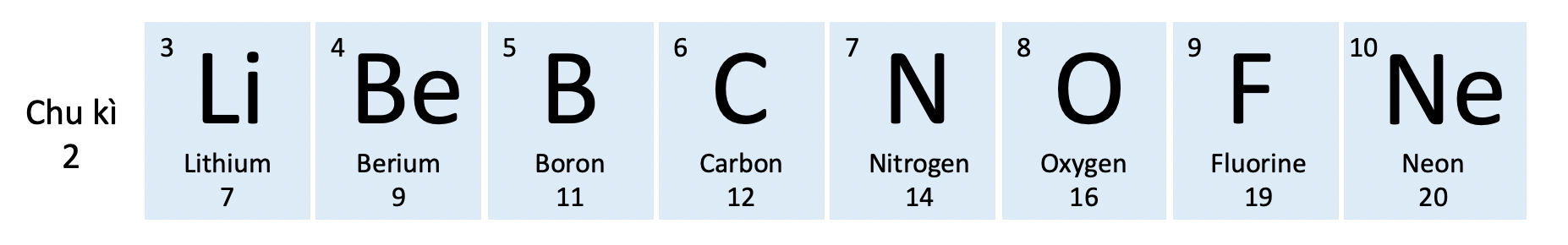 Chu kì 2 vô bảng tuần trả những nhân tố hoá học
Chu kì 2 vô bảng tuần trả những nhân tố hoá học
- Bảng tuần trả lúc này bao gồm 7 chu kì, được viết số từ một cho tới 7.
- Chu kì 1, 2, 3 được gọi tà tà những chu kì nhỏ, chu kì 4, 5, 6, 7 được gọi tà tà những chu kì rộng lớn.
Ví dụ 2: Chu kì 1 bao gồm nhì nhân tố H và He, chu kì 2 bao gồm 8 nhân tố kể từ Li cho tới Ne, chu kì 3 bao gồm 8 nhân tố kể từ Na cho tới Ar.
3. Nhóm
- Bảng tuần trả bao gồm 8 group A được viết số kể từ IA cho tới VIIIA và 8 group B được viết số kể từ IB cho tới VIIIB.
- Các nhân tố vô và một group A với số electron lớp bên ngoài nằm trong tương tự nhau, bởi vậy bọn chúng với đặc điểm hoá học tập tương tự động nhau.
- Trong và một group, Lúc chuồn kể từ bên trên xuống bên dưới, năng lượng điện phân tử nhân tăng dần dần.
- Số trật tự của tập thể nhóm A thông qua số electron lớp bên ngoài nằm trong vô vẹn toàn tử của nhân tố nằm trong group ê.
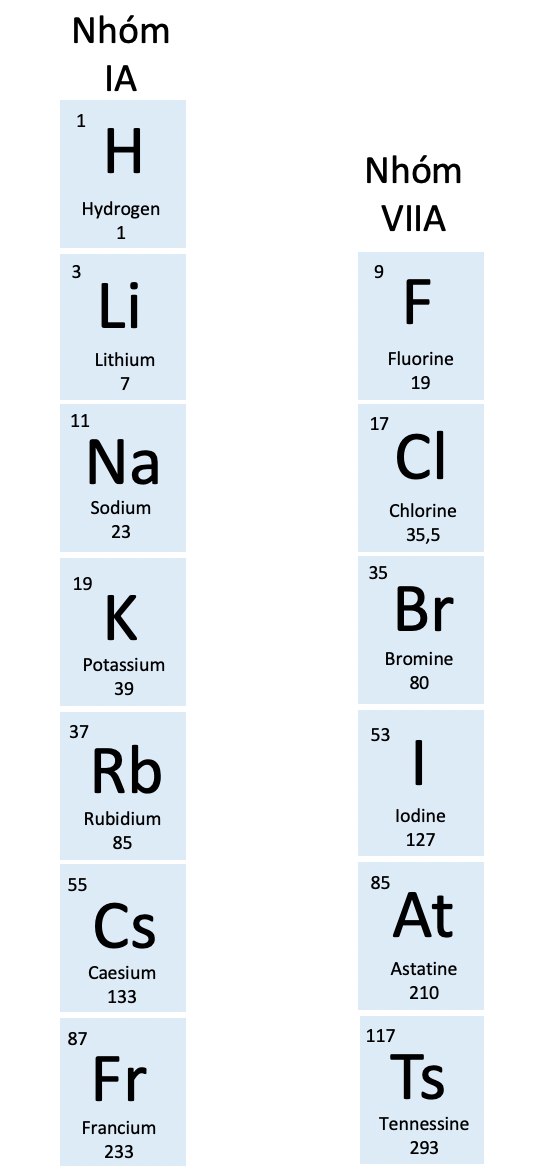
Nhóm IA và VIIA vô bảng tuần hoàn
III. Vị trí những group nhân tố sắt kẽm kim loại, phi kim và khí khan hiếm vô bảng tuần hoàn
1. Các nhân tố kim loại
- Trong số 118 nhân tố hoá học tập đang được biết với rộng lớn 90 nhân tố sắt kẽm kim loại.
- Vị trí nhân tố kim loại trong bảng tuần hoàn:
+ Hầu không còn những nhân tố nằm trong group IA, IIA, IIIA và một trong những nhân tố ở những group IVA, VA, VIA.
+ Các nhân tố nằm trong group IB cho tới VIIIB, những nhân tố lanthanide và actinide ở cuối bảng tuần trả.
 Ứng dụng của một trong những nhân tố sắt kẽm kim loại phổ biến vô đời sống
Ứng dụng của một trong những nhân tố sắt kẽm kim loại phổ biến vô đời sống
2. Các nhân tố phi kim
- Trong số 118 nhân tố hoá học tập đang được biết với không tới trăng tròn nhân tố là phi kim.
- Tại ĐK thông thường, bọn chúng hoàn toàn có thể ở thể rắn, thể lỏng hoặc thể khí.
- Vị trí nhân tố phi kim trong bảng tuần hoàn:
+ Hầu không còn những nhân tố nằm trong group VA, VIA, VIIA.
+ Một số nhân tố nằm trong group IIIA, IVA.
+ Nguyên tố H ở group IA.

3. Các nhân tố khí hiếm
- Trong số 118 nhân tố hoá học tập đang được biết với 7 nhân tố là nhân tố khí khan hiếm.
- Nguyên tử của bọn chúng với lớp electron ngoài nằm trong bền vững và kiên cố nên khó khăn bị thay đổi hoá học tập.
- Nguyên tố khí khan hiếm nằm tại vị trí group VIIIA vô bảng tuần trả.

Sơ loại tư duy: